El agua es uno de los recursos naturales más valiosos en nuestro planeta. Este líquido es tan importante porque ahí se originó la vida, y todos los procesos vitales de los seres vivos están asociados con el agua. Por otro lado, prácticamente cualquier actividad que intente realizar el hombre requiere de agua, para fines domésticos, agrícolas, actividades pesqueras, pecuarias o recreativas, uso industrial y de servicios.
El cuerpo Humano está compuesto de alrededor de dos tercios de agua; (70% en promedio), muchas frutas y vegetales estan compuestas del 80 a 90 % de agua. La leche, uno de nuestros alimentos básicos, tiene más de 90% de agua.
PROPEDADES FÍSICAS.
El agua pura es una sustancia: Insípida, incolora e inodora.Su punto de congelación es de 0°C
Punto de ebullición: 100°C a una atmósfera de presión.
La Densidad (ρ ) del agua es otro estándar de referencia, relaciona unidades métricas de volumen (mililitros) con unidades métricas de masa (gramos) a 4°C el agua tiene una densidad de 1g/ml.
ρ = 1g/ml.Esto significa que un gramo de agua a 4°C ocupa un volumen de 1 mililitro.
Si medimos exactamente 1 ml de H2O A 4°C; encontramos que tiene una masa de 1gr.
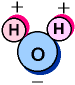
Formula química: H2O, quiere decir que 2 átomos de hidrógeno se ligan a uno de oxigeno formando un ángulo de 105 grados.
El agua es un compuesto muy estable: Sin embargo cuando se hace pasar una corriente eléctrica por ella, el agua se descompone: 2H2O | 2H2 + O2 | |
ELECTRICIDAD |
FÓRMULA QUÍMICA DEL AGUA
El agua reacciona con oxido de no metales para producir ácidos. EJEMPLO| El trióxido de azufre (SO3) + H2O | H2SO4 (ácido sulfúrico) | ||
| El dióxido de azufre (SO2) + H2O | H2SO3 (ácido sulfuroso) |
Una formula es la representación de la masa en que esta constituido un compuesto.
El H2O, nos dice que el agua contiene los elementos de hidrógeno H y de oxigeno O, también nos dice que cada unidad posee dos átomos de Hidrógeno y uno de oxigeno.
No indica, en cambio, si los átomos están unidos entre sí mediante electrones compartidos (enlaces covalentes) o mediante la atracción electrostática de iones de cargas opuestas (enlaces electrovalentes).

No hay comentarios:
Publicar un comentario